药用大麻种植:CBD增产因素研究

原标题:大麻二酚高产因素研究进展
摘 要:工业大麻是一种传统经济作物,大麻二酚(Cannabidiol, CBD)是工业大麻中特有的萜烯酚类化合物,具有镇痛、抗炎、抗抑郁、调节免疫、抗肿瘤等丰富的药理活性,医疗潜力强大。国际市场上CBD供不应求,CBD产量的提升备受国际关注。文章主要从影响CBD含量的遗传调控机制、外界环境因素等角度出发,对近5年CBD研究进展进行归纳、梳理和阐述,以期为CBD增产的深入研究提供参考依据,同时为药用大麻产业的发展提供新思路。

工业大麻是一种古老的作物,在我国种植历史悠久,据考证在南北朝时期已有种植,主要用于纺织、造纸、榨油等[1]。随着现代科技发展,工业大麻产业规模越发兴茂,上等的纤维麻制品可远销国外,优质的麻籽食品、食用油备受广大消费者青睐,雌花提取出的多种大麻素应用更加广泛,掀起新一轮的生物材料革命。
大麻素是工业大麻植株中特有的一类萜烯酚类化合物,可分为酚类物质和非酚类物质,其中酚类物质以大麻二酚(cannabidiol, CBD)、四氢大麻酚(Δ9-Tetrahydrocannabinol, THC)为主,大麻萜酚(cannabigerol, CBG)、大麻环萜酚(cannahichromene, CBC)的含量稍逊色,余下的100多种萜烯酚类物质含量较少[2],药用价值有待进一步开发。
在国际上,大麻通常分为毒品大麻和工业大麻,在我国根据THC和CBD含量,可进一步将其分为毒品大麻(THC含量高于0.3%)、工业大麻(THC含量低于0.3%,CBD含量低)、药用大麻(THC含量低于0.3%,CBD含量高)[3]。目前,药用大麻主要培育方向仍是高CBD含量大麻[4]。CBD的作用广泛,已证明其具有消炎镇痛、抗抑郁焦虑、治疗癌症等作用,近期研究[5-8]显示,CBD在皮肤病变治疗、创伤应激障碍治疗、抗COVID-19及其他呼吸系统疾病等方面也具有一定疗效,是一种多功能、疗效强、潜力深的医学原料。
国外对药用大麻的研究处于领先地位,受限于法规政策,国内药用大麻的发展起步较晚,但在一些领域的研究已赶超国外[9-11]。针对国际市场CBD供不应求的现状,诸多科研团队为缓解供需压力,在植株生长处理、田间管理改良、次生代谢通路及相关基因等方面均探究出CBD增产方法或主要影响因素的成果。本文针对影响CBD产量的遗传因素、外界环境因素进行系统性阐述,旨在为药用大麻产业的发展提供新思路。
1环境因素
在作物生长发育的进程中,除了受到内源遗传调控外,还易受到外界环境因素的影响,使得同一地块产出的生物量出现波动[12]。在工业大麻中,大麻素的产生与积累极易受到外界因素的影响。
1.1光照模式
工业大麻属于喜光、短日照植物,收获大麻素的主要工艺器官是雌花,雌花顶叶中大麻素含量最高,光照对于花期的影响较大,也是能够影响大麻素积累的主要环境因素之一。
在Eichhorn等[13]的研究中指出,美国将室内培育工业大麻列为能源密集型产业之一,室内PPFD(光合光子通量密度)达到1500μmol/m2/s时,可获得稳定、高产、高质量的大麻素。研究[14]表明,为植株提供特定波谱的光照,能够改变植株的形态,如:叶面积、叶片数量、花芽大小等。Mahlberg等[15]研究发现,使用约450μmol/m2/s的绿光照射工业大麻植株情况下,THC的含量呈现下降趋势;Magagnini等[16]证明在约450μmol/m2/s的蓝光(12h光照、12h黑暗)下种植的工业大麻,大麻素含量得到有效提升,类似地UV-A能够与蓝光协同促进大麻酚类物质的积累。在光照时间的研究中,张静等[17]发现光照强度为460μmol/m2/s情况下,12h光照的工业大麻植株CBD含量与8、10h光照处理的呈显著性差异。上述研究表明,在室内或田间种植工业大麻时,合理选择光周期时间、光谱波长可提高CBD的最终产出。
1.2土肥管理
工业大麻是一种具有抗旱能力的作物,适宜种植在透水性好、富砂土的坡岗地,黑龙江省种植药用大麻有一定历史,对田间土肥管理摸索出部分技术要点。
药用大麻温室种植的肥料管理尤为重要,为了保证秧苗的快速营养生长,至少需要施加能够提供90kg/hm2氮、60kg/hm2钾、40kg/hm2磷酸盐的肥料,同时增添其他特殊肥料有效提升CBD产量[18]。如可每周喷施稀释800倍的鲜牛奶以增加植株含钙量、乳酸菌含量和蛋白酶活性;浇水时可按照75kg/hm2添加鱼蛋白营养液,丰富植株有机质;在开花后叶面喷施600~1000倍甲壳素营养液,在花叶表面形成角质保护层降低CBD挥发损耗;收获花叶前15d,追加高质量钾肥,进一步促进CBD积累,同时避免次级代谢底物合成为THC。适宜的田间管理技术,是保障CBD增产、稳产的有效手段。
1.3生物胁迫
大麻素具有一定的抗虫性,使得工业大麻具有较好的抗虫能力。在McPartland[21]的统计中,约300种害虫能够对工业大麻植株造成损害,其中只有少数几种对植株的破坏力较强,可能造成经济效益的流失,如欧洲玉米螟虫(Ostrinia nubilalis)、大麻螟虫(Grapholita delineana)。Park等[22]的研究中,意外地发现烟草角虫(Manduca sexta)使得工业大麻植株中CBGA、CBG、CBD的含量明显降低,与预期的结果不同,推断烟草角虫的反流物抑制了植物的防御系统。在其他研究中[23],昆虫造成生物胁迫,是非常有效的大麻素含量提升刺激剂。不同的昆虫对CBD产量影响模式不同,适宜昆虫刺激产生的生物胁迫能否应用为增产技术,有待进一步挖掘。
1.4物理刺激
在生产中,除了通过土肥调整措施提高产量外,还可采用一些物理刺激提升大麻素的含量[19]。物理刺激的方法通常包括遮光处理、收获前降温或冷水浇灌、人工机械损伤等,通过刺激触发工业大麻植株的应激系统,促进次生代谢产物的产生,最终达到使CBD增产的目的。在程超华[20]的研究中,对工业大麻花期雌性植株材料的茎秆施加机械穿刺,在损伤后的2d内CBD和THC含量显著提升,JA、SA、ABA等激素水平也随之改变。鉴于成本偏高、操作复杂等方面原因,通过物理刺激提升CBD产量的研究相对较少。
1.5外源刺激
自发现植物激素以来,通过喷施外源激素来增产的方式已广泛应用于多种作物中[24],外源激素对大麻素的产生与积累的影响少有研究[25]。Apicella等[26]的研究证实,喷施茉莉酸甲酯(Me-JA)能够提升大麻素含量,在之前研究中JA被认为可能参与调控腺毛发育和次生代谢合成。吴姗[27]对于激素影响大麻素含量的研究比较深入,使用多种外源激素处理工业大麻材料,并测定大麻素含量以探寻合适的增产激素,其证实:200mg/L的ETH喷施工业大麻花叶能显著提升CBD产量,同时THC的含量也有所提升;喷施赤霉素(GA3)后,短期内能够提升CBD含量,随时间延长大麻素含量显著降低;20mg/L的激动素(KT)喷施花叶后,CBD可提高69.08%,增产一半以上,但THC的含量有所提升。外源激素虽能达到增产目的,但THC与CBD含量通常同步增加,多种外源激素联合喷施可能会产生抑制THC产量、提高CBD产出的效果,在工业大麻中该项研究尚为匮乏,在其他作物中有所试验[28]。
2遗传因素
自1995年鉴定得到四氢大麻酸合成酶(THCA)以来[29],大麻素合成途径备受关注,THC、CBD、CBG等主要大麻素的代谢途径目前已基本明了,关键的合成酶OAC、PT、AAE等已有所研究。随着科技进步,更多的合成酶基因、转录因子、激素信号分子、结构基因等为学者们发现和解析[30],进一步了解THC、CBD等大麻素的调控机理指日可待。
2.1腺毛发育
腺毛是植物外部防御的重要屏障之一,可分为分泌型和非分泌型,分泌型腺毛是工业大麻花叶中产生和存储大麻素的主要器官[31],分泌型腺毛根据形态特征可进一步分为头状有柄腺毛、头状无柄腺毛、球状腺毛[32],其中有柄腺毛能够产生的大麻素种类最多,且分泌能力最强[33]。目前工业大麻中腺毛发育的调控机制尚不清楚,但在其他植物中已有研究证实,R2R3-MYB和HD-ZIPIV(plant-specific homeodomain zipper family IV)转录因子家族参与到无柄腺毛发育为有柄腺毛的进程[34]。在Haiden等[35]的研究中,发现在本氏烟中过表达R2R3-MYB转录因子家族的CsMIXTA,能够增大腺毛的体型和密度,并促进分支的产生,工业大麻中过表达CsMIXTA可能会提升大麻素的产量。在Ma等[36]对工业大麻HD-ZIPIV转录因子的全基因组鉴定和表达分析中,鉴定到9个HD-ZIPIV转录因子,与拟南芥、水稻的HD-ZIPIV基因家族有共同的祖先,该基因家族中有4个主要在花中表达,可能参与到腺毛形态发育与次生代谢产物的调控。
在工业大麻的其他组织器官内大麻素的含量很低,因大麻素具有细胞毒性,会对正常的植物细胞产生一定的毒害,而腺毛细胞的抵御机制能够削弱毒性,使得大麻素主要存在于雌花中,同时细胞毒性也是工程菌生产大麻素难的主要原因之一。Wang等[37]对工业大麻转运蛋白MATE(Multidrug and toxic compound extrusion proteins)家族进行了鉴定与分析,发现MATEs蛋白除了能够转运植物激素、各种离子外,还可以转运大麻素到细胞内,避免其遭受不必要的修饰(如糖基化)和对细胞产生毒性;RT-PCR结果显示,CsMATEs家族的CsMATE23、CsMATE28和CsMATE34主要在花中表达,推测其可能参与到大麻素的转运,UV-B可以提升大麻素的产量,在UV-B处理下CsMATE23、CsMATE34的表达量有所提升,二者呈正相关,CsMATEs可能在大麻素的生物合成与分泌中发挥重要作用。多种转录因子与基因的研究,填补了腺毛发育分子机制的部分空白,为今后阐明腺毛发育和大麻素增产提供了新方向。
2.2花发育
花的发育情况也是影响大麻素产生与积累的主要因素,其他植物中调控花发育的基因在工业大麻中被认为具有相似的作用。如Lu等[38]的研究中:通过全基因组表达分析从工业大麻中共鉴定出51个bZIP基因家族成员,CsbZIP2、CsbZIP8、CsbZIP15和CsbZIP325等在花、苞片、茎和种子中均有表达,尤其是CsbZIP2、CsbZIP8在花和苞片中呈高表达;已证实水稻中bZIP56、bZIP64、bZIP79参与酚类和萜类化合物的合成[39],CsbZIP25、CsbZIP32的结构与之十分相似,亲缘关系较近,推断其可能参与大麻素的合成。
陈晗等[40]对工业大麻PEBP基因家族分析中,共鉴定出12个PEBPs基因,主要参与到光形态建成、花的发育和调控等,该基因家族的启动子中多包含光反应顺式调节元件、脱落酸反应顺式作用元件以及茉莉酸响应元件等,其他参与花期的基因CsCOL、CsHd3a也有类似的元件[41]。上述提到的CsMATE23等的启动子中同样包含丰富的光响应顺式作用元件,而在外源激素喷施的研究中,茉莉酸能够提升大麻素的含量,推测PEBP基因家族等FT家族成员与大麻素的产生与积累存在一定联系。
2.3汉麻 AL 转录因子保守基序及基因结构分析
大麻素及相关酶类主要在腺毛中合成和分泌,基本的代谢合成途径已阐述明了[42]。整个合成途径以CBGA为中心前体,CBGA主要由两个前体物质OLA和GPP经过异戊烯基转移酶(PT)合成而来,其中OLA是2-甲基赤藓糖醇磷酸(MEP)途径合成的乙酰辅酶A在聚酮合酶(OLS)催化下产生,而GPP来自焦磷酸香叶酯(GPP)合成途径;随后CBGA作为前体物质,经由不同的合成酶氧化环化成不同的大麻素,如大麻二酚酸合酶(CBDAS)催化产生CBDA,四氢大麻酸合酶(THCAS)催化产生THCA,这些大麻素还可进一步变化为同系物或其他大麻素。
大麻素的代谢途径较长,提升底物浓度能够提高大麻素的最终产量,对DXR、DXS、HDR、HDS、MCT、MDS、OAC、PT等参与前体物质合成的基因如何受到调控尚不明朗,目前多数研究主要针对大麻素合成酶展开。常丽等[43]对CBDA1进行生物学分析,发现该基因编码544个氨基酸,其二级结构丰富,包含较多蛋白质修饰及活化位点,表明CBDA1在体内受多种因子调控。潘根等[44]对CBDAS基因家族进行全基因组鉴定,共分析出5个成员,部分成员在雌蕊中表达量很高,该家族基因的启动子中普遍存在较多光响应元件,且激素响应元件含量丰富,证实光照、激素是影响CBD产量的重要因素;在针对高CBD品种与低CBD品种的表达量鉴定中,高CBD品种CBDAS1的表达量显著增加。姜颖等[45]对CsTHCA进行克隆,结果发现:该基因共编码545个氨基酸,证实基因的多态性是不同品种THC含量差异的主要原因,且CsTHCA的表达量与THC含量呈现正相关;简单的提高底物浓度或丰富CsCBDAS表达量仅能在一定限度内提升CBD产量,中间或旁支代谢通路可能会截取前体物质,通过分子育种手段抑制CsTHCA的表达实现CBD产量提升是可行的。
3结语与展望
药用成分CBD的增产一直是药用大麻领域的研究热点,众多学者在药用大麻生长发育进程中选取不同的切入点,从腺毛的发育到花的建成,从植株的营养生长时期到工艺成熟期,从土肥管理到物理刺激,针对CBD含量提升进行深入的研究,为指导药用大麻产业发展提供了丰富的数据基础。
在许多研究[46-47]中,影响CBD含量的因素间接或直接指向了光照和植物激素,对不同基因(如bZIP、PEBP、CBDAS等)进行生物信息学分析,均在启动子区域发现了光反应元件或植物激素响应元件,其他转录因子如C2H2、GRAS等也被证实参与到大麻素的合成,二者在响应逆境胁迫中具有重要作用,与本文所述的物理刺激或胁迫能够提升大麻素含量的研究不谋而合。因而,探究外界环境因素的影响,要与内源遗传因素相结合才能进一步了解大麻素合成与积累的奥秘。
除本文叙述的产量提升方法外,一些学者对新方向进行了尝试,如CBD原材料提取方法的改良,Tiago等[48]使用DESs取代常规的提取液,能够有效保留CBD的生物活性,减少叶绿素和蜡质等杂质留存并大幅提高萃取率。生物工程菌生产大麻素因大麻素的生物毒性很难实现,但在Luo等[49]的努力下,酵母生产大麻素成为现实,通过给工程菌株喂食不同的脂肪酸辅以简单的化学合成进行补充,得到了大麻素类似物。自Mechoulam等[50]确定CBD结构以来,已有诸多学者通过化工手段实现了CBD的合成[51],基因改造酵母合成大麻素是工业大麻合成生物学领域的创举,有望构建完整的大麻素体外合成产业链。
在其他作物中有“理想株型”的理念,在药用大麻领域,也可以存在类似的期望,即通过多种生物学手段培育出高前体底物、高表达CBDAS、基因敲除或沉默THAS且能够正常生长发育的药用大麻品种,辅以合适的田间水肥、光照管理,并在收获前进行合适的物理刺激,最终获得高产CBD。室内培育药用大麻技术还需要进一步探索,可尝试提高正常光照的光强和补充UV-A和蓝光等光质来促进CBD的产生和积累。本文就影响CBD产生与积累的主要因素进行总结,进一步拓宽CBD的研究方向,为药用大麻产业提供合理导向。
参考文献:
[47]张苗苗,于江珊,施江,等.大麻GRAS转录因子全基因组研究[J].中草药,2021,52(5):1423-1433.
来源:大麻二酚高产因素研究进展[J].中国麻业科学,2023,45(05):254-260.
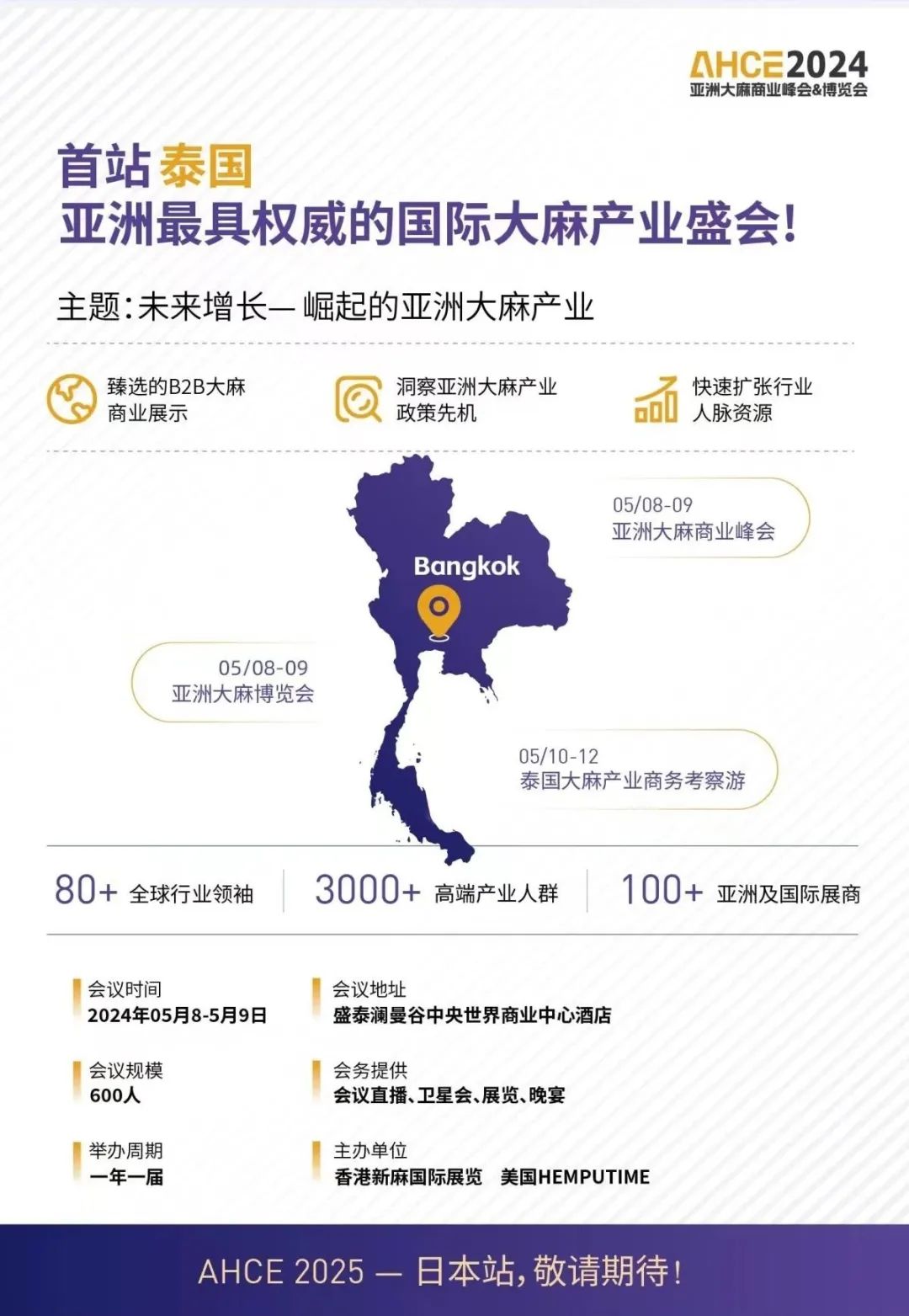
2024年5月8日-9日
【亚洲大麻商业峰会&博览会——泰国站】
即将启幕,敬请关注!
欢迎咨询峰会合作、展位等
联系人:新麻君 电话:15900924547(同V)


我们坚决反对一切中国国内的娱乐性大麻和毒品,本文部分内容来源于媒体网络,转载目的是分享更多资讯信息,如作品内容、版权问题,请于30天内与小编联系,我们将第一时间核实并删除。文章内容观点归作者所有、不完全代表本站观点,不构成任何投资或应用建议,且对本声明及活动拥有最终解释权。